-
Prodotti
-
Strumenti da laboratorio
-
Misuratori e sonde di laboratorio
Standard per taratura Misuratori e sonde Sension+
- Sostanze chimiche, reagenti e standard
-
Analizzatori online
Analizzatori di ammonio Analizzatori di cloro
- CL17sc
- CL10 sc Amperometrico
- 9184 sc Amperometrico
- Analizzatore colorimetrico di cloro CL17sc Basso Range
Analizzatori di fosfato- NP6000sc
- Sistema FX610/FX620
- Sistema Filtrax
- 5500 sc
- 9611 sc
- Analizzatore Phosphax sc LR
- NP6000sc Chemistry/Reagents
- Phosphax Sigma
- Phosphax sc
Analizzatori della serie EZ- Ferro
- Alluminio
- Manganese
- Fosfato
- Cloruro
- Cianuro
- Fluoruro
- Solfato
- Solfuro
- Arsenico
- Cromo
- Rame
- Nichel
- Zinco
- Ammonio
- Azoto totale
- Fosforo totale
- Fenolo
- Acidi grassi totali
- Alcalinità
- ATP
- Durezza
- Tossicità
- Pretrattamento dei campioni
- Boro
- Colore
- Nitrato
- Nitriti
- Silice
- Perossido di idrogeno
- EZ Series Reagents
- EZ Series Accessories
- Serie EZ sc - Complessi inorganici
- Serie EZ sc - Metalli
- Serie EZ sc - Nutrienti
-
Sensori e controller on-line
Controller digitali (trasmettitori) Controller (analogici)
- SC4500
- Orbisphere 366x Ex
- Orbisphere 410/510 diossido di carbonio
- Orbisphere 410/510 ossigeno
- Orbisphere 51x idrogeno
Sensori per pH e ORP- 1200-S Redox
- 1200-S pH
- 12mm pH/Redox
- 8362 sc elevata purezza
- Cominazione pH/Redox
- LCP Redox
- Redox digitale differenziale
- pH differenziale
- pH digitale differenziale
Sensori di conducibilità- 3400 contatto analogico
- 3400 contatto digitale
- 3700 induttivo analogico
- 3700 induttivo digitale
- 3798 sc senza elettrodo
- 9523 conduttività cationica
- 9525 DCCP System
- Sistemi da laboratorio automatizzati
- Multiparameter Online Panels
- Claros Water Intelligence System
- Campionamento
-
Forniture e attrezzature per laboratori
ApparatoLibretti e materiale di riferimento Materiali di consumo generici per laboratoriStrumenti Vetreria/Articoli in plastica
- Kit test e striscette
-
Microbiologia
Accessori e sostanze chimiche Articoli per laboratoriTerreni disidratati Terreni pronti
- Elettrochimica
-
Strumenti da laboratorio
- PARAMETRI
-
Soluzioni software
-
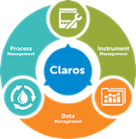
Claros Water Intelligence System
Aspetti chiave dei prodotti Process Management
- Soluzioni per:
- Rimozione di BOD/COD
- Nitrificazione/denitrificazione
- Rimozione del fosforo
- Gestione dei fanghi
Data Management- Soluzioni per:
- Raccolta
- Visualizzazione e analisi
- Generazione di report
- Accuratezza dei dati
Instrument Management- Soluzioni per:
- Manutenzione
- Risoluzione dei problemi
- Accesso remoto
- Confronto tra laboratorio e processo
-
Claros Water Intelligence System
- Industrie
- Servizi
- Notizie ed Eventi
Italia
Scegli il Paese o Regione:
Europe
Americas
Asia - Australasia
- Australia
- Mainland China
- India
- Indonesia
- Japan
- Malaysia
- New Zealand
- Philippines
- Singapore
- South Korea
- Thailand (Thai)
- Taiwan
- Vietnam
Middle East - Africa
Ammoniaca e ammonio
Cos'è l'ammoniaca?
L'ammoniaca è un composto gassoso, incolore e pungente, di idrogeno e azoto (un atomo di azoto e tre atomi di idrogeno, NH 3) altamente solubile in acqua.
Si forma naturalmente come prodotto del decadimento microbiologico della materia organica azotata (proteine animali e vegetali). Può anche essere prodotta per l'uso in fertilizzanti o per la produzione di materie plastiche, prodotti farmaceutici e altre sostanze chimiche.
La presenza di ammoniaca nelle acque sotterranee è normale a causa dei processi microbiologici. Tuttavia, l'azoto ammoniacale riscontrato nell'acqua di superficie indica in genere un inquinamento domestico. L'ammoniaca in eccesso può danneggiare la vegetazione ed è altamente tossica per le forme di vita acquatiche, soprattutto a livelli elevati di pH e temperatura.
Soluzione acquosa ammoniacale
Per varie applicazioni l'ammoniaca viene disciolta in acqua per produrre "soluzione ammoniacale". Le soluzioni sfuse di ammoniaca acquosa (soluzioni ammoniacali) sono instabili e la concentrazione di ammoniaca può diminuire durante il trasporto o la conservazione. Pertanto, le soluzioni consegnate vengono fatturate in base alla concentrazione di ammoniaca fornita all'impianto o all'utente finale.
Cos'è l'ammonio?
L'ammonio è un composto contenente un atomo di azoto e quattro atomi di idrogeno (NH 4 +). Mentre l'ammoniaca è una molecola neutra non ionizzata (base debole), l'ammonio è uno ione che porta una carica positiva. Inoltre, l'ammoniaca emette un odore forte mentre l'ammonio è completamente inodore.
Il fattore più importante per determinare il rapporto tra ammoniaca e ammonio nell'acqua è il pH. L'attività dell'ammoniaca è influenzata anche dalla forza ionica e dalla temperatura della soluzione. È importante ricordare che mentre l'ammoniaca molecolare può essere nociva per gli organismi acquatici, lo ione ammonio è sostanzialmente innocuo. Nel settore dell'acqua, è importante conoscere le concentrazioni di azoto legato all'idrogeno. Pertanto, i termini ammoniaca e ammonio sono utilizzati in modo intercambiabile, indicati rispettivamente con NH 3 -N o NH 4 -N e in genere espressi in mg/L o ppm di N.
La relazione fra ammoniaca e ammonio è controllata dalla seguente equazione chimica:
NH 3 + H 2O <-> NH 4 + + OH -
Quando il pH è basso l'equilibrio si sposta a destra, mentre quando è alto si sposta a sinistra. In generale, a temperatura ambiente con un pH inferiore a 6, la frazione di ammoniaca‐N come NH 3 è molto bassa e quasi tutto l'azoto ammoniacale è presente come NH 4 +. A un pH di circa 8, la frazione di NH 3 è minore o uguale al 10%, mentre per un pH lievemente superiore a 9 tale frazione è attorno al 50%. Quando il pH è superiore a 11, tutti gli ioni ammonio in soluzione vengono convertiti nella forma molecolare ossia in ammoniaca. L'attività dell'ammoniaca acquosa è molto più bassa alle basse temperature.
Perché monitorare l'ammoniaca?
L'ammoniaca viene utilizzata sia come reagente sia come parametro di misurazione in diverse aree del trattamento dell'acqua e delle acque reflue.
- L'ammoniaca presente in natura viene monitorata nell'acqua di sorgente.
- Durante il processo di disinfezione con cloraminazione, l'ammoniaca viene combinata con il cloro per trattare l'acqua potabile e mantenere una disinfezione residua di lunga durata nei sistemi di distribuzione.
- A volte l'ammoniaca viene utilizzata per il controllo del pH, ad esempio nell'industria farmaceutica.
- L'ammoniaca è ampiamente monitorata nei processi di nitrificazione e denitrificazione delle acque reflue.
Sebbene generalmente innocua a basse concentrazioni, alte concentrazioni di ammoniaca possono causare danni e comportare rischi per la salute. Pertanto, i livelli di ammoniaca devono essere adeguatamente monitorati e mantenuti.
Hach® è in grado di offrirti gli strumenti di analisi, le risorse, la formazione e il software necessari per monitorare e gestire con successo i livelli di ammoniaca nella tua specifica applicazione di processo.
Prodotti in primo piano per il monitoraggio dell'ammoniaca
Analizzatore di ammonio NH6000sc
Progettato per una facile installazione all'aperto, l'analizzatore di ammonio NH6000sc è costruito per ridurre la manutenzione, semplificare il campionamento e offrire un sistema di filtraggio leggero. Ottiene risultati di alta qualità con tempi di risposta ridotti.
Acquista oraHach offre molti dei migliori spettrofotometri nel settore dell'analisi delle acque.
Acquista subitoGli strumenti portatili robusti e facili da usare di Hach sono realizzati per gestire le sollecitazioni uniche presenti sul campo.
Acquista subitoElettrodo Intellical ISENH3181 ionoselettivo (ISE) per ammoniaca (NH₃), cavo da 1 m
Il multimetro da laboratorio Hach HQ440D è un misuratore da laboratorio avanzato che elimina ogni incertezza nelle misure.
Acquista subitoElettrodo Intellical ISENH4181 ionoselettivo (ISE) per ammonio (NH₄⁺), cavo da 3 m
I misuratori HQD® si collegano agli elettrodi IntelliCAL® intelligenti che riconoscono automaticamente il parametro di test.
Acquista subitoLa serie HQ è destinata ai professionisti della qualità dell'acqua che desiderano eseguire analisi elettrochimiche in laboratorio e sul campo.
Acquista subitoAnalizzatore di ammonio Amtax sc
L'analizzatore online Amtax sc di Hach con elettrodo sensibile al gas è progettato per stabilire con elevata precisione la concentrazione di ammonio direttamente in corrispondenza del processo di trattamento (installazioni all'esterno).
Acquista subitoAnalizzatori di ammonio della serie EZ
Gli analizzatori online della serie EZ offrono varie opzioni per il monitoraggio dell'ammonio nell'acqua.
Acquista subitoLa sonda iono-selettiva digitale A-ISE sc di Hach è progettata per determinare la concentrazione di ammonio direttamente nel campione
Acquista subitoIl sensore digitale combinato AN-ISE sc di Hach per ammonio e nitrato esegue misure dirette e continue utilizzando un elettrodo iono-selettivo.
Acquista subitoAnalizzatore parallelo portatile SL1000
L'analizzatore portatile parallelo Hach SL1000 (PPA) esegue le stesse analisi con meno della metà delle operazioni manuali normalmente richieste.
Acquista subitoSostanze chimiche, reagenti e standard
Hach si impegna a fornire reagenti di alta qualità per analisi delle acque di routine e complesse.
Acquista subito
Quali processi richiedono il monitoraggio dell'ammoniaca?
Trattamento delle acque potabili
L'ammoniaca gassosa e le sue soluzioni concentrate devono essere manipolate con cautela e in conformità ai requisiti OSHA (o di altri enti normativi competenti). Ciò a causa delle proprietà altamente corrosive che comportano gravi rischi per la salute, che vanno da lievi irritazioni degli occhi o della pelle a ustioni chimiche, a seconda della concentrazione. Inoltre, il rilascio di ammoniaca può causare problemi estetici come sapore o odore sgradevole.
Quando l'ammoniaca non viene utilizzata per la disinfezione, la sua presenza in un sistema di distribuzione può indicare la lisciviazione dai materiali utilizzati nella struttura delle tubazioni o la contaminazione dell'acqua a causa di danni al sistema. Quando l'ammoniaca indesiderata si combina con il cloro, diminuisce la forza di disinfezione della clorazione.
Cloraminazione
In alcuni processi di disinfezione, l'ammoniaca viene intenzionalmente combinata con il cloro per produrre monoclorammina. Sebbene il cloro libero sia un disinfettante più potente, la monoclorammina (ammoniaca e cloro legati) ha un residuo più forte e pertanto rimane nel sistema di distribuzione più a lungo, garantendo così che la disinfezione venga mantenuta fino al rubinetto. Inoltre, le clorammine reagiscono in modo meno intenso con varie impurità nell'acqua non depurata, in particolare le sostanze organiche, riducendo al minimo la formazione di alcuni sottoprodotti di disinfezione cancerogeni (DBP). Per ottimizzare il processo di cloraminazione, è importante monitorare la formazione delle specie disinfettanti target, evitando al contempo la formazione delle specie meno desiderabili diclorammina o triclorammina (tricloruro di azoto). Il test della monoclorammina viene utilizzato insieme a una determinazione dell'ammoniaca libera per garantire la formazione del disinfettante giusto e ridurre i costi delle materie prime evitando un dosaggio eccessivo di cloro e/o ammoniaca.
Ammoniaca libera
L'ammoniaca che non si è legata al cloro durante la disinfezione con cloraminazione viene definita ammoniaca libera (sia NH 4 + che NH 3). A pH neutro e temperatura ambiente, quasi tutta l'ammoniaca libera esiste come NH 4 +. Con l'aumentare del pH e della temperatura, la quantità di NH 3 aumenta mentre la quantità di NH 4 + diminuisce. Quando viene rilasciata acqua sottoposta a cloraminazione, i livelli di ammoniaca libera aumentano poiché la monoclorammina reagisce con vari composti organici e batteri nell'acqua del sistema di distribuzione, soddisfacendo la domanda di cloro. Un aumento dei livelli di ammoniaca libera indica l'insorgenza del fenomeno della nitrificazione. Un improvviso calo dell'ammoniaca libera suggerisce che la nitrificazione è in corso e che si sta formando nitrito. Il valore di ammoniaca libera è utile per determinare la quantità di cloro libero necessaria per aumentare il residuo di monoclorammina in una stazione di rilancio. Il livello di ammoniaca libera può essere ridotto aggiungendo cloro libero in rapporto 5:1 come Cl 2:N per guidare il processo e ridurre al minimo il potenziale di nitrificazione.
Ammoniaca totale
L'ammoniaca totale è la somma di tutto l'azoto ammoniacale presente sotto forma di monoclorammina (NH 2Cl), altre clorammine, ione ammonio (NH 4 +) e ammoniaca molecolare (NH 3). Questo parametro può essere utilizzato come verifica primaria o secondaria per mantenere il processo di cloraminazione sotto controllo.


Trattamento di acque di superficie/sotterranee
L'ammoniaca si forma come sotto-prodotto quando i batteri decompongono i materiali naturali nel terreno. Elevate concentrazioni di ammoniaca possono essere causate da terreni ricchi di ferro, dalla prossimità a foreste o fertilizzanti o dalla contaminazione fecale.

Trattamento delle acque reflue
Durante il trattamento delle acque reflue, i livelli di ammoniaca possono raggiungere concentrazioni estremamente elevate a causa dell'azione batterica. L'ammoniaca viene prima convertita in nitrato attraverso il processo di nitrificazione, in modo da poter essere ridotta ad azoto atmosferico (N2) per denitrificazione. Ulteriori informazioni sul trattamento delle acque reflue municipali. Ad alte concentrazioni e pH elevato, l'ammoniaca può essere tossica per i microbi di digestione dei fanghi. Inoltre, per evitare danni alla vita acquatica, è fondamentale monitorare e rimuovere l'ammoniaca dall'effluente delle acque reflue prima che venga rilasciata nei corpi idrici naturali.

Acquacoltura
Come prodotto di scarto della vita acquatica, l'ammoniaca può essere tossica per i pesci e le piante acquatiche a livelli di soli 0,5 mg/L. Negli acquari l'ammoniaca può essere rapidamente convertita in nitrito e infine nitrato. La maggior parte degli acquari punta a ottenere una presenza di ammoniaca pari a zero.
Negli ambienti acquatici naturali, elevati livelli di ammoniaca possono causare una crescita eccessiva delle alghe che blocca la luce solare, compromette la ricerca di cibo con la vista e la fotosintesi.

Agricoltura
Poiché le piante non sono in grado di fissare l'azoto direttamente dall'atmosfera, si affidano ai batteri fissatori di azoto per convertire l'azoto in ammoniaca. L'azoto sotto forma di ammoniaca può quindi essere utilizzato dalle piante per creare altre molecole organiche essenziali necessarie per gli organismi complessi. Per agevolare o migliorare questo processo naturale (che fa parte del ciclo dell'azoto), ai fertilizzanti viene spesso aggiunta ammoniaca. Ad esempio, le soluzioni di nutrienti idroponici introducono l'azoto come sale di ammoniaca. Anche l'ammoniaca può essere presente nel terreno a causa del dosaggio dell'urea e della sua successiva decomposizione.

Fabbricazione di prodotti farmaceutici
Nell'industria farmaceutica, l'ammoniaca viene utilizzata per il controllo del pH e la sua soluzione viene utilizzata per rigenerare resine a scambio ionico debole e per la regolazione del pH.
Come viene monitorata l'ammoniaca?
Metodo con salicilato
Il metodo con salicilato è una variante del noto metodo con fenato, ma ha il vantaggio di essere privo di sali di mercurio e fenolo. Questo metodo è particolarmente utile per le determinazioni dell'azoto ammoniacale a range basso. Sebbene la procedura comporti più passaggi prima che venga sviluppato il colore verde finale, tutti i reagenti sono contenuti in pratici Powder Pillows (reagente salicilato in Powder Pillows e cianurati alcalini in Powder Pillows) o in una combinazione di Powder Pillows e cuvette LCK.
- I composti dell'ammoniaca reagiscono con l'ipoclorito formando monoclorammina.
- La monoclorammina reagisce quindi con il salicilato formando 5-aminosalicilato.
- L'ossidazione del 5-aminosalicilato viene eseguita in presenza di un catalizzatore, nitroprussiato (chiamato anche nitroferricianuro), che determina la formazione di indosalicilato, un composto di colore blu. Il colore blu è mascherato dal colore giallo (dall'eccesso di nitroprussiato) formando una soluzione di colore verde. L'intensità del colore verde risultante è direttamente proporzionale alla concentrazione di ammoniaca nel campione.
Acque reflue o acque ambientali |
Cloraminazione |
|
Da banco: Metodo con Powder Pillows 8155 Portatile: Kit per test dell'ammoniaca, NI-SA Online: |
Portatile: Chemkey per ammoniaca libera e monoclorammina Monoclorammina/ammoniaca libera DR300 Da banco: Spettrofotometro DR3900 per l'analisi di monoclorammina/ammoniaca libera Online: |

Sonda di rilevamento gas
L'elettrodo per ammoniaca misura l'ammoniaca gassosa in soluzioni acquose o gli ioni ammonio che sono stati convertiti in gas in seguito all'aggiunta di una base forte. L'elettrodo è una cella elettrochimica completa costituita da un elettrodo per pH in vetro e da un elettrodo di riferimento. La membrana permeabile al gas separa il campione da uno strato sottile di elettrolita premuto tra il bulbo per pH e la membrana. A pH elevato, lo ione ammonio viene convertito in ammoniaca gassosa. Il gas si diffonde attraverso la membrana e causa una variazione del pH nello strato sottile di elettrolita. Il potenziale attraverso il vetro pH varia a seguito della variazione del pH e l'elettrodo misura la variazione di potenziale. La variazione del pH misurata è proporzionale alla concentrazione di ammoniaca nella soluzione.
Da banco/portatile:
Elettrodo IntelliCAL® ISENH3181 iono-selettivo (ISE) per ammoniaca (NH3)
Online:
Metodo Nessler
Nel test dell'ammoniaca, il reagente di Nessler (K 2HgI 4) reagisce con l'ammoniaca presente nel campione (in condizioni fortemente alcaline) per produrre una specie di colore giallo. L'intensità del colore è direttamente proporzionale alla concentrazione di ammoniaca.
2 K 2HgI 4 + NH 3 + 3 KOH → Hg 2OINH 2 + 7 KI + 2 H 2O
Da banco:
Online:
Domande frequenti
Quali metodi è possibile utilizzare per segnalare l'ammoniaca nelle acque reflue all'EPA?
L'azoto ammoniacale può essere misurato utilizzando uno spettrofotometro (o un colorimetro) o un elettrodo iono-selettivo (ISE) per ammoniaca. Di seguito sono indicati i metodi accettati o equivalenti dell'Agenzia per la protezione dell'ambiente degli Stati Uniti (USEPA) per l'analisi delle acque reflue.
Metodo Nessler per l'azoto ammoniacale 8038 - accettato dall'USEPA per l'analisi delle acque reflue (distillazione necessaria), metodo 350.2.
Metodo LCK per l'azoto ammoniacale 10205 - equivalente; LCK è conforme a metodo UNI11669
Metodo per l'azoto ammoniacale con elettrodo iono-selettivo (ISE) 10001 e 10002 - queste procedure possono essere utilizzate per metodi standard per l'analisi dell'acqua e delle acque reflue 4500-NH3 e per la segnalazione USEPA NPDES.
Perché i reagenti salicilato per ammoniaca LCK sono equivalenti a EPA, mentre i reagenti salicilato TNT AMVER non lo sono?
I set di reagenti per ammoniaca LCK304, LCK305 e LCK303 sono totalmente conformi al metodo UNI11669 ed equivalenti per l'analisi e la refertazione delle acque reflue dell'Agenzia per la protezione dell'ambiente degli Stati Uniti (USEPA). I set di reagenti per ammoniaca TNT AMVER non sono considerati equivalenti per la refertazione USEPA.
In Italia gli LCK sono totalmente conformi al metodo UNI11669. Hach ha creato un metodo formattato EPA con dati di supporto affiancati per seguire le regole EPA e l'equivalenza di stato per i reagenti salicilato per ammoniaca LCK. Questa operazione non è stata eseguita per i reagenti salicilato TNT AMVER meno recenti. Se un utente desidera prendere in considerazione i precedenti test di ammoniaca TNT per la conformità alle normative, può comunque discuterne con il proprio ente per l'accreditamento.
Fare riferimento al metodo formattato EPA "TNTplus Ammonia-Spectrophotometric Measurement of Ammonia Nitrogen and Total Kjeldahl Nitrogen in Water and Wastewater" per informazioni sull'equivalenza USEPA a 350.1 e 351.1.
I metodi Nessler e salicilato rilevano l'ammoniaca o l'ammonio?
Sia il metodo Nessler sia quello con salicilato si basano su una reazione con ammoniaca molecolare in una soluzione basica. Se il campione originale conteneva ioni ammonio, i reagenti basici lo convertirebbero in ammoniaca molecolare, che quindi reagirebbe e contribuirebbe al risultato finale del test. Tuttavia, questi semplici test dell'ammoniaca non includono l'ammoniaca dei gruppi amminici legati in composti organici. Un test reale dell'ammoniaca totale includerebbe le clorammine e richiederebbe il riscaldamento del campione in una soluzione acida per digerire l'ammoniaca organica.
Poiché il risultato del test è una somma sia dell'ammoniaca molecolare (NH 3) sia dell'ammonio ionico (NH 4 +), l'unità di misura preferita per la refertazione è l'azoto (NH 3 -N). La maggior parte dei colorimetri e degli spettrofotometri Hach offre la possibilità di convertire i risultati dei test tra azoto, ammoniaca e ammonio. Ciò non modifica la chimica del test, ma modifica solo le unità. Si noti che, sebbene vi sia la stessa quantità di azoto nell'ammoniaca e nell'ammonio, il rapporto stechiometrico tra N ed NH 3 ed NH 4 + non è esattamente uguale a causa del diverso numero di atomi di idrogeno.
- Per convertire da mg/L di NH 3 -N a mg/L di NH 3, moltiplicare per 1,216.
- Calcolato in base alla massa di NH 3 divisa per la massa di N (17.034 ÷ 14.01 = 1.216).
- Per convertire da mg/L di NH 3 -N a mg/L di NH 4, moltiplicare per 1,288.
- Calcolato in base alla massa di NH 4 + divisa per la massa di (18.042 ÷ 14.01 = 1.288).
Cosa misura effettivamente l'analizzatore Amtax sc?
Quando la misura viene visualizzata sull'Amtax sc, le unità sono "NH 4 -N" o "NH 4", il che significa che la misura dello strumento è espressa come ammonio e riporta i valori come azoto (anche descritto come "NH 4 come N"), o come ammonio. Non vi è alcuna differenza tra l'espressione della concentrazione di ammoniaca ("NH 4 -N" o "NH 3 -N") perché in entrambi i casi viene calcolata come azoto, la cui quantità è la stessa in entrambe le forme di ammoniaca.
L'analizzatore Amtax sc aggiunge idrossido di sodio (NaOH) per regolare il pH e convertire gli ioni ammonio (NH 4 +) in ammoniaca gassosa (NH 3), che passa attraverso una membrana selettiva per l'ammoniaca gassosa e causa una variazione di pH di una soluzione elettrolitica. Questa variazione di pH nell'elettrolita viene misurata come un segnale mV proporzionale alla concentrazione di ammoniaca (NH 3) nel campione.
Quale concentrazione di ammoniaca è tossica per i pesci?
L'ammoniaca è presente nell'acqua sotto forma di ioni ammonio (NH 4 +) o ammoniaca non ionizzata (NH 3). L'ammoniaca non ionizzata è tossica per i pesci, mentre gli ioni ammonio sono atossici tranne in caso di concentrazioni estremamente elevate. A pH neutro 7 e a temperatura ambiente, quasi tutta l'ammoniaca è presente sotto forma di NH 4 +. Con l'aumentare del pH e della temperatura, la quantità di NH 3 aumenta mentre la quantità di NH 4 + diminuisce.
Per misurare la concentrazione di ammoniaca non ionizzata in un campione, attenersi alla seguente procedura:
- Misurare la concentrazione di ammoniaca utilizzando qualsiasi metodo per l'ammoniaca, ad eccezione del metodo per ammoniaca libera.
- Misurare il pH e la temperatura del campione. Fare riferimento alla tabella "Percentage Un-ionized Ammonia in Aqueous Solution by pH Value and Temperature Calculated from data in Emerson, et. al*” a pagina 11 del manuale FF2 Freshwater Aquaculture Test Kit Manual.
- Determinare la percentuale di NH 3 utilizzando la tabella, il pH del campione e la temperatura del campione.
- Moltiplicare la concentrazione di ammoniaca per la percentuale riportata nella tabella, quindi dividere per 100.
DOCUMENTI
- ISO9001 certificato
- SA8000 certificato
- UNIPDR certificato
- Politica Qualità Ambiente e Sicurezza
- Condizioni generali di Vendita per prodotti Hach Lange Srl
- Sicurezza dei prodotti
- Codice Etico
- Politica Whistleblowing
- Calendario
- ISO14001 Certificato
- ISO45001 Certificato
- Soluzioni per l'analisi dell'acqua – per il laboratorio e sul campo
- SA8000 – Politica per la parità di genere
- SA8000 – Informazioni al lavoratore
- SA8000 – Social Accountability
- SA8000 – Istruzione Operativa